Introduction : Un Mythe de la Vie Quotidienne
Quand Toucher n’est Pas Toucher
Avez-vous déjà réfléchi à ce que signifie vraiment toucher quelque chose ? En physique, le contact direct entre deux objets est une illusion fascinante. Bien que nous percevions un contact solide lorsque nous nous asseyons sur une chaise ou touchons un objet, la réalité atomique est bien différente.
Imaginez la scène : vous vous cognez l’orteil contre une table et ressentez une douleur aiguë. Vous pourriez penser que vos atomes et ceux de la table se sont réellement rencontrés. En fait, ce n’est pas le cas. Ce que vous ressentez est le résultat d’une interaction complexe entre les forces électromagnétiques à l’échelle atomique.
Les atomes, les blocs de construction fondamentaux de la matière, sont principalement constitués de vide. Si le noyau d’un atome était agrandi à la taille d’un ballon de football, les électrons qui l’entourent orbiteraient à une distance équivalente à celle d’un stade de football entier. Cela signifie que la majeure partie de l’espace que nous percevons comme solide est en réalité vide.
Pour mieux comprendre, entrons dans le monde des forces fondamentales, en commençant par l’électromagnétisme. La force électromagnétique est celle qui empêche les objets de se traverser mutuellement. À l’échelle atomique, cette force est des milliards de fois plus puissante que la gravité. Les électrons autour des atomes se repoussent mutuellement, créant une barrière invisible mais impénétrable. Ainsi, lorsque vous ressentez une pression ou une résistance, comme en touchant une surface, vous ne ressentez pas un contact direct entre les atomes, mais la force électromagnétique qui oppose une résistance.
L’Univers de Vide : La Structure Atomique Dévoilée
Bienvenue dans l’Empire du Vide : Où les Atomes Prennent leurs Quartiers
Plongeons dans le monde microscopique pour comprendre pourquoi le contact direct entre les objets est une illusion. Commençons par la structure fondamentale de la matière : les atomes.
Les atomes sont composés d’un noyau central, constitué de protons et de neutrons, entouré par des électrons en orbite. Cependant, cette description simplifiée masque une vérité fascinante : la majeure partie d’un atome est en réalité vide.
Pour illustrer cela, imaginons que nous agrandissions un atome à une taille où son noyau mesurerait environ un mètre de diamètre. Les électrons qui orbitent autour de ce noyau se trouveraient alors à près de 100 mètres de distance. En d’autres termes, si le noyau d’un atome était aussi gros qu’un ballon de football, les électrons seraient comme de minuscules mouches volant autour à la distance d’un stade de football entier. Entre le noyau et les électrons, il n’y a pratiquement rien d’autre que du vide.
Ce vide n’est pas vide de sens. La disposition des électrons autour du noyau crée des régions où il est probable de les trouver, formant ce que l’on appelle des « nuages électroniques ». Ces nuages déterminent les propriétés chimiques des atomes et la façon dont ils interagissent entre eux.
La Densité Atomique et l’Échelle de Vide
La densité d’un atome est essentiellement concentrée dans son noyau. Les protons et les neutrons, qui composent le noyau, sont maintenus ensemble par une force appelée interaction forte. Cette force est extrêmement puissante à courte distance, mais elle s’affaiblit rapidement à mesure que l’on s’éloigne du noyau.
Pour donner une idée de la proportion de vide dans un atome, considérons le rapport entre le volume du noyau et celui de l’ensemble de l’atome. Si on prend le rayon d’un noyau typique à environ ![]() mètres et le rayon de l’atome à environ
mètres et le rayon de l’atome à environ ![]() mètres, le rapport des volumes est de l’ordre de
mètres, le rapport des volumes est de l’ordre de ![]() . Cela signifie que le noyau occupe une fraction incroyablement petite du volume total de l’atome, le reste étant essentiellement du vide.
. Cela signifie que le noyau occupe une fraction incroyablement petite du volume total de l’atome, le reste étant essentiellement du vide.
Le Modèle de Bohr et au-delà
Historiquement, le modèle atomique de Bohr a été une étape cruciale dans notre compréhension de la structure atomique. Dans ce modèle, les électrons orbitent autour du noyau à des distances fixes, un peu comme les planètes autour du soleil. Cependant, ce modèle a été amélioré par la mécanique quantique, qui introduit la notion de probabilités et de nuages électroniques. Selon cette théorie, les électrons n’ont pas des orbites précises mais des régions où ils sont plus susceptibles de se trouver.
Les Forces à l’Œuvre
La stabilité des atomes et la structure de leurs nuages électroniques sont principalement régies par deux forces fondamentales :
- Interaction forte : Cette force maintient les protons et les neutrons ensemble dans le noyau. Elle est extrêmement puissante mais agit sur de très courtes distances, de l’ordre de
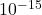 mètres.
mètres. - Interaction électromagnétique : Cette force attire les électrons chargés négativement vers le noyau chargé positivement et repousse les électrons entre eux, créant des nuages électroniques. Elle est responsable de la plupart des phénomènes que nous associons aux interactions atomiques et moléculaires.
En comprenant ces forces et la structure atomique, nous commençons à voir pourquoi le monde que nous percevons comme solide est en réalité rempli de vide. Cette perspective nous prépare à explorer les forces qui empêchent les atomes de se toucher, ce qui sera notre prochain chapitre.
La Force Électromagnétique : Gardienne des Distances
Super Électrons et la Force du Club Électromagnétique
Maintenant que nous comprenons la structure atomique et le vide qui compose la majeure partie des atomes, plongeons dans les forces qui maintiennent ces structures et empêchent les objets de se traverser mutuellement.
La Puissance de l’Électromagnétisme
L’électromagnétisme est l’une des quatre forces fondamentales de la nature, et à l’échelle atomique, elle est de loin la plus influente. Cette force agit entre les particules chargées, comme les protons et les électrons. Les protons, chargés positivement, attirent les électrons, chargés négativement, ce qui maintient les électrons en orbite autour du noyau. Cependant, les électrons eux-mêmes se repoussent mutuellement en raison de leur charge négative identique.
Loi de Coulomb
La force électromagnétique entre deux charges ponctuelles est décrite par la loi de Coulomb :
![]()
où :
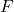 est la force entre les charges,
est la force entre les charges,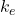 est la constante de Coulomb (
est la constante de Coulomb (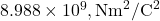 ),
),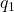 et
et 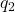 sont les valeurs des charges,
sont les valeurs des charges, est la distance entre les centres des deux charges.
est la distance entre les centres des deux charges.
Cette force explique pourquoi les électrons, en se repoussant, ne permettent pas aux atomes de se rapprocher trop près les uns des autres. En fait, c’est cette répulsion électromagnétique qui crée ce que nous percevons comme la « solidité » des objets.
Potentiel de Lennard-Jones
Pour mieux comprendre comment les atomes interagissent à des distances plus courtes, les physiciens utilisent souvent le potentiel de Lennard-Jones, qui modélise la variation de l’énergie potentielle entre deux atomes ou molécules en fonction de leur distance :
![]()
où :
 est la profondeur du puits de potentiel (indiquant la force de l’attraction),
est la profondeur du puits de potentiel (indiquant la force de l’attraction),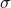 est la distance à laquelle le potentiel est nul,
est la distance à laquelle le potentiel est nul, est la distance entre les atomes.
est la distance entre les atomes.
Ce potentiel montre une répulsion forte à très courte distance (le terme ![]() ) et une attraction plus faible à des distances intermédiaires (le terme
) et une attraction plus faible à des distances intermédiaires (le terme ![]() ). Cela illustre pourquoi les atomes se repoussent fortement lorsqu’ils sont très proches, empêchant ainsi un contact direct.
). Cela illustre pourquoi les atomes se repoussent fortement lorsqu’ils sont très proches, empêchant ainsi un contact direct.
L’Interdiction du Chevauchement Quantique
En plus des forces classiques, la mécanique quantique introduit un concept important : le principe d’exclusion de Pauli. Ce principe stipule que deux fermions (particules comme les électrons) ne peuvent pas occuper le même état quantique simultanément. En d’autres termes, deux électrons ne peuvent pas avoir exactement la même position et la même énergie dans un atome.
Ce principe joue un rôle crucial dans la formation des structures atomiques et moléculaires, renforçant encore l’idée que les atomes ne peuvent jamais vraiment se toucher. Lorsque les électrons commencent à se rapprocher trop près, le principe d’exclusion de Pauli crée une répulsion supplémentaire, contribuant à la solidité perçue des objets.
L’Illusion du Contact
Lorsque nous touchons une surface, ce que nous ressentons n’est pas un contact direct entre les atomes de notre peau et ceux de la surface. Au lieu de cela, nous ressentons la force électromagnétique qui résulte de la répulsion entre les électrons de nos atomes et ceux de la surface. Cette force est si puissante qu’elle donne l’impression d’un contact solide, bien que, techniquement, nos atomes ne se touchent jamais vraiment.
En résumé, la force électromagnétique est le principal gardien des distances à l’échelle atomique, empêchant les atomes de se rapprocher trop près et créant l’illusion de la solidité. Dans le prochain chapitre, nous explorerons comment les atomes forment des liaisons et des structures plus complexes, malgré leur tendance à se repousser.
Gravité vs Électromagnétisme : Un Match de Lutte à l’Échelle Atomique
David (Électromagnétisme) contre Goliath (Gravité) : Le Combat Inégal
Pour bien comprendre pourquoi les atomes ne se touchent jamais vraiment, il est essentiel de comparer la force électromagnétique avec une autre force fondamentale que nous connaissons bien : la gravité. À l’échelle humaine, la gravité est la force dominante qui façonne notre quotidien. Pourtant, à l’échelle atomique, elle est presque insignifiante par rapport à l’électromagnétisme.
La Gravité à l’Échelle Atomique
La gravité est la force d’attraction entre deux masses, décrite par la loi de la gravitation universelle de Newton :
![]()
où :
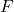 est la force de gravité entre deux masses,
est la force de gravité entre deux masses,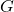 est la constante gravitationnelle (
est la constante gravitationnelle (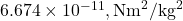 ),
),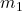 et
et 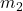 sont les masses des deux objets,
sont les masses des deux objets, est la distance entre les centres des deux masses.
est la distance entre les centres des deux masses.
Comparaison des Forces
À l’échelle atomique, les masses des particules sont extrêmement petites, ce qui rend la force gravitationnelle entre elles presque négligeable. Comparons cela à la force électromagnétique entre deux charges élémentaires, comme un proton et un électron.
Pour un proton et un électron séparés par une distance de ![]() mètres, la force gravitationnelle est :
mètres, la force gravitationnelle est :
![]()
où :
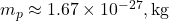 (masse du proton),
(masse du proton),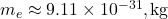 (masse de l’électron),
(masse de l’électron),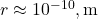 .
.
Calculons cette force :
![]()
Maintenant, calculons la force électromagnétique entre un proton et un électron à la même distance, selon la loi de Coulomb :
![]()
où :
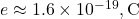 (charge de l’électron et du proton),
(charge de l’électron et du proton),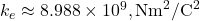 .
.
Calculons cette force :
![]()
La comparaison de ces deux forces montre que la force électromagnétique est des ordres de grandeur plus puissante que la force gravitationnelle à l’échelle atomique :
![]()
Conséquences Pratiques
Cette différence massive explique pourquoi la gravité peut être ignorée dans les interactions atomiques et moléculaires. La force électromagnétique domine complètement, déterminant les structures et les interactions à cette échelle. Ainsi, la gravité, qui façonne les planètes et les galaxies, n’a que peu d’influence sur les particules élémentaires qui composent la matière.
Dans les contextes où la gravité devient significative, comme dans les étoiles ou les trous noirs, les conditions sont extrêmement différentes de celles que nous rencontrons dans notre vie quotidienne. Ces environnements extrêmes peuvent forcer les atomes à se rapprocher beaucoup plus près, menant à des phénomènes comme la fusion nucléaire, que nous explorerons dans les chapitres suivants.
En résumé
La force électromagnétique est le « David » qui écrase le « Goliath » gravitationnel à l’échelle atomique. Cette force est responsable de la structure et des interactions de la matière, expliquant pourquoi les atomes ne peuvent jamais vraiment se toucher et créant l’illusion de la solidité que nous percevons. Dans le prochain chapitre, nous plongerons dans la formation des liaisons chimiques et la création des molécules, les véritables bâtisseurs de notre monde matériel.
Nuages Électroniques et Répulsion : Pourquoi les Atomes se Comportent comme des Aimants Timides
Le Côté Socialement Distant des Atomes
Maintenant que nous comprenons les forces en jeu à l’échelle atomique, explorons plus en détail comment les électrons et leurs nuages influencent les interactions atomiques. Les électrons ne se contentent pas de créer une barrière ; ils façonnent également la manière dont les atomes interagissent et se lient entre eux.
Structure des Nuages Électroniques
Les électrons dans un atome ne sont pas distribués de manière uniforme. Ils occupent des régions spécifiques autour du noyau appelées « orbitales », qui peuvent être visualisées comme des nuages électroniques. Ces nuages ne sont pas des trajectoires fixes mais des régions où il est probable de trouver un électron à un moment donné.
La distribution des électrons dans ces orbitales est déterminée par des règles de la mécanique quantique, notamment le principe d’exclusion de Pauli et la règle de Hund. Le principe d’exclusion de Pauli stipule que deux électrons ne peuvent pas avoir les mêmes quatre nombres quantiques dans un atome, ce qui les force à occuper des états différents.
Principe d’Exclusion de Pauli
Ce principe, formulé par Wolfgang Pauli en 1925, est crucial pour comprendre la structure des atomes et des molécules. Il stipule que deux fermions (particules de spin demi-entier comme les électrons) ne peuvent pas occuper le même état quantique simultanément. Cela signifie que chaque électron dans un atome doit avoir une combinaison unique de nombres quantiques.
En termes simples, si un électron est déjà dans une certaine région avec un certain spin, aucun autre électron ne peut être exactement dans le même état. Cette règle crée une répulsion supplémentaire lorsque les électrons sont forcés à se rapprocher, empêchant les atomes de se chevaucher complètement.
Répulsion Électronique et Force de Pauli
La répulsion entre les électrons est due non seulement à leurs charges identiques (répulsion coulombienne), mais aussi au principe d’exclusion de Pauli. Cette répulsion est particulièrement forte à courte distance, empêchant ainsi les atomes de se toucher. Le potentiel de Lennard-Jones, mentionné précédemment, prend en compte cette répulsion à très courte distance.
Illustration du Potentiel de Lennard-Jones
Le potentiel de Lennard-Jones, qui modélise l’interaction entre deux atomes, montre clairement cette répulsion :
![]()
- Le terme
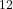 représente la forte répulsion à courte distance due à la superposition des nuages électroniques et au principe d’exclusion de Pauli.
représente la forte répulsion à courte distance due à la superposition des nuages électroniques et au principe d’exclusion de Pauli. - Le terme
 représente l’attraction à plus longue distance, typique des forces de van der Waals.
représente l’attraction à plus longue distance, typique des forces de van der Waals.
Interaction et Formation de Liaisons
Lorsqu’un atome s’approche d’un autre, leurs nuages électroniques interagissent. Si les conditions sont favorables, les électrons peuvent se réarranger pour minimiser l’énergie du système, formant ainsi des liaisons chimiques. Ces liaisons ne signifient pas que les atomes se touchent directement, mais que leurs nuages électroniques se chevauchent suffisamment pour partager ou échanger des électrons.
Types de Liaisons Chimiques
- Liaisons Covalentes : Les atomes partagent des paires d’électrons. Par exemple, dans une molécule de H₂, deux atomes d’hydrogène partagent leurs électrons pour former une liaison covalente.
- Liaisons Ionique : Un atome donne un ou plusieurs électrons à un autre, créant des ions opposés qui s’attirent. Par exemple, dans le chlorure de sodium (NaCl), le sodium perd un électron pour devenir Na⁺, et le chlore gagne un électron pour devenir Cl⁻.
- Liaisons Métalliques : Les électrons sont délocalisés sur un réseau d’atomes métalliques, permettant la conduction de l’électricité et la malléabilité des métaux.
Illustration avec la Molécule de H₂
Considérons la formation d’une molécule de H₂. Deux atomes d’hydrogène, chacun avec un électron dans son orbital 1s, s’approchent l’un de l’autre. Si la distance entre les atomes est appropriée, les électrons peuvent se partager, formant une liaison covalente. La fonction d’onde du système moléculaire, décrite par la mécanique quantique, montre une distribution de probabilité où les électrons sont plus susceptibles de se trouver entre les deux noyaux, minimisant l’énergie totale du système.
Cette exploration des nuages électroniques et de la répulsion explique pourquoi les atomes restent à distance même lorsqu’ils interagissent fortement pour former des liaisons. Dans le prochain chapitre, nous verrons comment ces liaisons permettent la formation de molécules et d’objets solides complexes, donnant naissance à la diversité des matériaux que nous observons.
Liaisons Chimiques : L’Art de Partager des Électrons
Méli-Mélo Moléculaire : Les Secrets des Solides
Les atomes, bien qu’ils ne se touchent jamais vraiment, peuvent s’associer pour former des structures plus complexes appelées molécules. Les liaisons chimiques sont à la base de la formation des molécules et des solides, et elles résultent de l’interaction entre les électrons des atomes. Explorons comment ces liaisons se forment et comment elles déterminent les propriétés des matériaux.
Liaisons Covalentes : Partage d’Électrons
Les liaisons covalentes sont le résultat du partage de paires d’électrons entre atomes. Ce type de liaison se produit principalement entre non-métaux. Lorsque deux atomes partagent des électrons, ils forment une liaison covalente, stabilisant ainsi les deux atomes en atteignant une configuration électronique plus stable.
Considérons l’exemple de la molécule de dihydrogène (H₂). Chaque atome d’hydrogène a un électron dans son orbital 1s. Lorsque deux atomes d’hydrogène se rapprochent, leurs électrons peuvent être partagés, formant une liaison covalente simple :
![]()
La distance entre les deux noyaux d’hydrogène dans la molécule est appelée longueur de liaison, et l’énergie nécessaire pour rompre cette liaison est appelée énergie de liaison.
Liaisons Ionique : Transfert d’Électrons
Les liaisons ioniques se forment lorsque des électrons sont transférés d’un atome à un autre, créant des ions chargés qui s’attirent mutuellement. Ce type de liaison se produit principalement entre un métal et un non-métal.
Prenons l’exemple du chlorure de sodium (NaCl). Le sodium (Na) a un électron de valence qu’il peut facilement perdre, tandis que le chlore (Cl) a besoin d’un électron pour compléter sa couche de valence. Le sodium perd son électron pour devenir un ion positif (Na⁺), et le chlore gagne un électron pour devenir un ion négatif (Cl⁻) :
![]()
![]()
Les ions Na⁺ et Cl⁻ s’attirent, formant une liaison ionique et créant un réseau cristallin solide de NaCl.
Liaisons Métalliques : Nuage d’Électrons Délocalisés
Les liaisons métalliques se forment entre atomes de métal. Dans ce type de liaison, les électrons de valence sont délocalisés et partagés librement parmi tous les atomes du métal, formant un « nuage » d’électrons. Ce nuage d’électrons permet aux métaux de conduire l’électricité et la chaleur, et leur confère également des propriétés comme la malléabilité et la ductilité.
Les Propriétés des Liaisons Chimiques
Les propriétés des liaisons chimiques déterminent les caractéristiques des substances qu’elles forment. Par exemple :
- Les substances covalentes ont souvent des points de fusion et d’ébullition relativement bas, car les liaisons covalentes dans les molécules discrètes sont relativement faibles.
- Les composés ioniques ont des points de fusion et d’ébullition élevés, car les forces électrostatiques entre les ions sont très fortes.
- Les métaux sont généralement ductiles, malléables et bons conducteurs de chaleur et d’électricité en raison de la délocalisation des électrons.
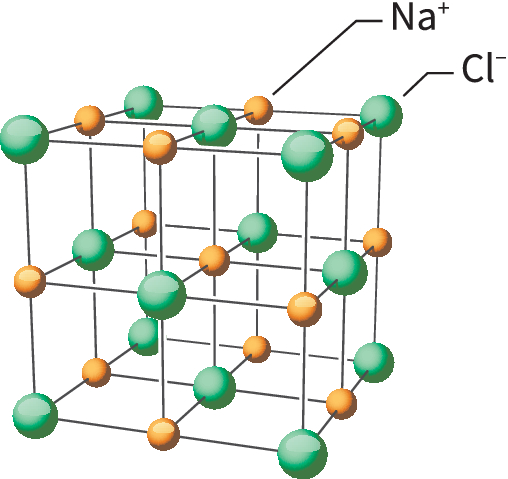
Les Réseaux Cristallins
Les atomes peuvent s’arranger en structures régulières appelées réseaux cristallins. Les réseaux cristallins sont typiques des solides ioniques et métalliques. Par exemple, dans le réseau cristallin du chlorure de sodium, chaque ion Na⁺ est entouré de six ions Cl⁻, et chaque ion Cl⁻ est entouré de six ions Na⁺, formant une structure cubique.
![]() :
:
Conclusion du Chapitre
Les liaisons chimiques permettent aux atomes de former des structures stables et variées, allant des molécules simples aux réseaux cristallins complexes. Ces liaisons, bien que ne permettant pas un contact direct entre les atomes, sont essentielles pour la formation et les propriétés des solides. Dans le prochain chapitre, nous examinerons comment les forces à très courte distance et les dipôles atomiques jouent un rôle crucial dans les interactions à l’échelle nanométrique.
Forces à Très Courte Distance : Attraction et Répulsion à l’Échelle Nano
Les Geckos et la Polarisation : L’Adhérence sans la Colle
À l’échelle nanométrique, les forces électromagnétiques jouent un rôle crucial dans les interactions entre atomes et molécules. Ces forces, bien que faibles à grande échelle, deviennent dominantes lorsque les distances sont extrêmement courtes. Examinons les interactions à très courte distance et comment certains organismes exploitent ces forces pour des effets surprenants.
Forces de van der Waals
Les forces de van der Waals sont des interactions faibles qui se produisent entre les atomes et les molécules en raison de la polarisation temporaire de leurs nuages électroniques. Ces forces comprennent trois types principaux :
- Forces de London (ou forces de dispersion) : Elles résultent de la polarisation instantanée et induite entre des atomes ou des molécules non polaires. Même dans les atomes neutres, les électrons peuvent, à un moment donné, se trouver plus d’un côté du noyau, créant un dipôle instantané. Ce dipôle peut induire une polarisation similaire dans un atome voisin, conduisant à une attraction.
- Forces de Debye : Elles se produisent entre une molécule polaire et une molécule non polaire. La molécule polaire peut induire un dipôle dans la molécule non polaire, créant ainsi une attraction.
- Forces de Keesom : Elles se produisent entre des molécules polaires permanentes. Ces dipôles permanents s’alignent de manière à minimiser l’énergie, créant une attraction.
Le Potentiel de Lennard-Jones Revisitée
Les forces de van der Waals peuvent être modélisées par le potentiel de Lennard-Jones que nous avons vu précédemment :
![]()
- Le terme latex^{12}[/latex] représente la répulsion à très courte distance due à la superposition des nuages électroniques.
- Le terme latex^{6}[/latex] représente l’attraction à plus longue distance due aux forces de van der Waals.
L’Adhérence des Geckos
Les geckos sont célèbres pour leur capacité à adhérer à diverses surfaces sans utiliser de colle. Leur secret réside dans des millions de poils microscopiques appelés « setae » présents sur leurs pattes. Chaque seta se divise en milliers de brins encore plus petits appelés « spatulae », qui maximisent le contact avec la surface à l’échelle nanométrique.
Les forces de van der Waals entre les spatulae et la surface permettent aux geckos de générer une force d’adhérence suffisante pour supporter leur poids. Cette adhérence est due à la grande surface de contact total entre les spatulae et la surface, multipliant ainsi les faibles forces de van der Waals pour créer une adhésion significative.
Polarisation et Adhérence Temporaire
Un autre exemple d’adhésion basée sur la polarisation est illustré par un ballon frotté contre un tissu. En frottant, le ballon acquiert une charge électrostatique, qui peut polariser les molécules de la surface sur laquelle il est appliqué, générant une attraction temporaire. Cette polarisation est due à la redistribution des électrons, montrant comment des forces électromagnétiques peuvent influencer le comportement des objets à une échelle macroscopique.
Applications Technologiques
Comprendre et exploiter les forces de van der Waals a conduit à des innovations dans la nanotechnologie et les matériaux. Par exemple, les chercheurs développent des adhésifs inspirés des geckos, capables de fonctionner dans des environnements variés et de supporter des charges importantes. De plus, les interactions à courte distance jouent un rôle crucial dans la conception de nano-machines et de dispositifs médicaux.
Ce qu’il faut retenir
Les forces à très courte distance, bien que faibles individuellement, peuvent avoir des effets significatifs lorsqu’elles sont multipliées sur de grandes surfaces ou dans des environnements confinés. Ces forces expliquent des phénomènes naturels étonnants, comme l’adhérence des geckos, et inspirent des technologies innovantes. Dans le prochain chapitre, nous explorerons les réactions chimiques, où les atomes interagissent pour former de nouvelles substances, transformant les propriétés des matériaux de manière spectaculaire.
Réactions Chimiques : Quand les Atomes Passent à l’Action
Histoires d’Amour et de Rupture Atomique
Les réactions chimiques sont des processus au cours desquels les atomes se réarrangent pour former de nouvelles substances. Ces transformations sont fondamentales pour la chimie et la biologie, car elles expliquent comment les composés sont formés, décomposés, et comment l’énergie est échangée. Plongeons dans le monde fascinant des réactions chimiques et voyons comment les atomes passent à l’action.
Types de Réactions Chimiques
Les réactions chimiques peuvent être classées en plusieurs types, chacun ayant des caractéristiques et des mécanismes distincts. Voici quelques-uns des principaux types de réactions :
- Réactions de Synthèse :
- Dans ces réactions, deux ou plusieurs substances simples se combinent pour former une substance plus complexe.
- Exemple :
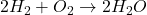
- Réactions de Décomposition :
- Une substance complexe se décompose en deux ou plusieurs substances plus simples.
- Exemple :
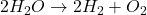
- Réactions de Substitution Simple :
- Un élément remplace un autre élément dans un composé.
- Exemple :
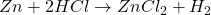
- Réactions de Double Substitution :
- Les ions de deux composés échangent leurs places pour former deux nouveaux composés.
- Exemple :
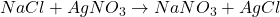
- Réactions de Combustion :
- Une substance réagit rapidement avec l’oxygène, libérant de l’énergie sous forme de chaleur et de lumière.
- Exemple :
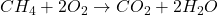
Équilibres Chimiques et Cinétique
Dans de nombreuses réactions chimiques, les réactifs ne se transforment pas entièrement en produits. Au lieu de cela, un équilibre dynamique est atteint, où les réactions directes et inverses se produisent à des taux égaux. Cet équilibre peut être décrit par la constante d’équilibre, ![]() :
:
![]()
où :
![Rendered by QuickLaTeX.com [A]](https://pourton.info/wp-content/ql-cache/quicklatex.com-88d32eb57852b9d236f34e937a03de75_l3.png) ,
, ![Rendered by QuickLaTeX.com [B]](https://pourton.info/wp-content/ql-cache/quicklatex.com-d8908cd587f5e0160dcddfba1d4b56a4_l3.png) ,
, ![Rendered by QuickLaTeX.com [C]](https://pourton.info/wp-content/ql-cache/quicklatex.com-c01dd89cf3e871779a9e1e59c15e2322_l3.png) ,
, ![Rendered by QuickLaTeX.com [D]](https://pourton.info/wp-content/ql-cache/quicklatex.com-aca9db0a1b71e58ee5182d312376d5f5_l3.png) sont les concentrations des réactifs et des produits,
sont les concentrations des réactifs et des produits, ,
, 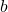 ,
,  ,
, 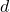 sont les coefficients stœchiométriques de la réaction.
sont les coefficients stœchiométriques de la réaction.
Réactions Exothermiques et Endothermiques
Les réactions chimiques peuvent également être classées en fonction de l’énergie échangée :
- Réactions Exothermiques :
- Ces réactions libèrent de l’énergie, généralement sous forme de chaleur.
- Exemple : La combustion du méthane
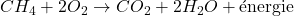
- Réactions Endothermiques :
- Ces réactions absorbent de l’énergie de leur environnement.
- Exemple : La décomposition de l’oxyde de mercure
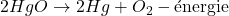
Exemple : Formation du Chlorure de Sodium
Prenons un exemple classique de réaction chimique : la formation du chlorure de sodium (NaCl) à partir de sodium (Na) et de chlore (Cl₂).
- Ionisation du Sodium :
- Le sodium perd un électron pour former un ion sodium positif.
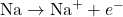
- Formation de l’Ion Chlorure :
- Le chlore, sous forme de molécule diatomique, gagne un électron pour former deux ions chlorure négatifs.
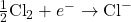
- Formation de NaCl :
- Les ions sodium et chlorure s’attirent électrostatiquement pour former du chlorure de sodium solide.
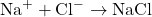
L’Importance des Catalyseurs
Dans certaines réactions, la vitesse peut être augmentée par l’utilisation de catalyseurs. Un catalyseur est une substance qui augmente la vitesse d’une réaction chimique sans être consommée par la réaction elle-même. Les catalyseurs fonctionnent en abaissant l’énergie d’activation nécessaire pour que la réaction se produise.
La Stabilité des Molécules : Pourquoi Certaines Sont Plus Stables que d’Autres
Les Liaisons Chimique et Leur Robustesse
La stabilité des molécules est un concept clé en chimie, car elle détermine leur réactivité et leur comportement dans diverses conditions. La stabilité d’une molécule dépend de plusieurs facteurs, notamment la nature des liaisons chimiques, la distribution des électrons et les interactions entre atomes. Explorons les principes qui régissent la stabilité moléculaire.
Liaisons et Énergies de Liaison
Les liaisons chimiques sont des forces qui maintiennent les atomes ensemble au sein d’une molécule. La force et la stabilité d’une liaison chimique peuvent être évaluées par l’énergie de liaison, qui est l’énergie nécessaire pour rompre la liaison entre deux atomes.
Par exemple, la liaison covalente dans une molécule de dihydrogène (H₂) a une énergie de liaison d’environ 436 kJ/mol. Cela signifie qu’il faut 436 kJ pour rompre une mole de liaisons H-H.
Liaisons Simples, Doubles et Triples
Les molécules peuvent avoir des liaisons simples, doubles ou triples, chaque type ayant des énergies de liaison différentes :
- Liaison Simple :
- Partage d’une paire d’électrons.
- Exemple :
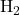 , avec une énergie de liaison de 436 kJ/mol.
, avec une énergie de liaison de 436 kJ/mol.
- Liaison Double :
- Partage de deux paires d’électrons.
- Exemple :
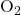 , avec une énergie de liaison de 498 kJ/mol.
, avec une énergie de liaison de 498 kJ/mol.
- Liaison Triple :
- Partage de trois paires d’électrons.
- Exemple :
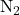 , avec une énergie de liaison de 941 kJ/mol.
, avec une énergie de liaison de 941 kJ/mol.
Les liaisons triples sont généralement plus fortes et plus courtes que les liaisons doubles, qui sont elles-mêmes plus fortes et plus courtes que les liaisons simples.
Effets de Résonance et Hybrides de Résonance
Certaines molécules bénéficient d’un effet de résonance, où les électrons sont délocalisés sur plusieurs atomes, augmentant la stabilité de la molécule. Par exemple, la molécule de benzène (C₆H₆) a une structure de résonance où les doubles liaisons sont réparties également sur les six atomes de carbone, ce qui stabilise la molécule.
Hybridation des Orbitales
L’hybridation des orbitales atomiques est un autre facteur influençant la stabilité moléculaire. L’hybridation permet aux atomes de former des liaisons plus fortes et plus stables en combinant leurs orbitales atomiques en orbitales hybrides.
Par exemple, le carbone dans le méthane (CH₄) subit une hybridation sp³, où une orbitale s et trois orbitales p se combinent pour former quatre orbitales hybrides équivalentes. Cela permet au méthane de former quatre liaisons covalentes fortes et stables.
Électronégativité et Polarité
La différence d’électronégativité entre les atomes peut également affecter la stabilité des liaisons chimiques. Les molécules avec des liaisons polaires, où les électrons sont partagés de manière inégale, peuvent avoir des interactions dipôle-dipôle qui affectent leur stabilité.
Par exemple, dans une molécule d’eau (H₂O), l’oxygène est plus électronégatif que l’hydrogène, créant des liaisons O-H polaires. Les interactions entre les dipôles de différentes molécules d’eau (liaisons hydrogène) contribuent à la stabilité et aux propriétés uniques de l’eau.
Stabilité Thermodynamique et Cinétique
La stabilité d’une molécule peut être évaluée de deux façons :
- Stabilité Thermodynamique :
- Déterminée par l’énergie libre de Gibbs (ΔG).
- Une molécule est thermodynamiquement stable si ΔG est négatif pour sa formation à partir de ses éléments constitutifs.
- Stabilité Cinétique :
- Déterminée par l’énergie d’activation (Ea) nécessaire pour une réaction.
- Une molécule peut être cinétiquement stable si la barrière énergétique pour sa décomposition est élevée, même si elle n’est pas thermodynamiquement stable.
Exemple : Stabilité du Chlorure de Sodium (NaCl)
Prenons l’exemple du chlorure de sodium (NaCl), un composé ionique. Sa stabilité est due à la forte attraction électrostatique entre les ions Na⁺ et Cl⁻ dans un réseau cristallin.
- Formation de NaCl :
- Énergie de Réseau :
- La stabilité de NaCl est renforcée par l’énergie de réseau, qui est l’énergie libérée lorsque les ions se combinent pour former le réseau cristallin. Cette énergie est très élevée, ce qui rend NaCl très stable.
On retient que
La stabilité des molécules est influencée par une multitude de facteurs, allant de la nature des liaisons chimiques et des effets de résonance à l’hybridation des orbitales et aux différences d’électronégativité. Comprendre ces facteurs nous permet de prédire et d’expliquer la réactivité des substances chimiques. Dans le prochain chapitre, nous explorerons les gaz nobles, des éléments particuliers qui illustrent parfaitement le concept de stabilité chimique grâce à leurs configurations électroniques uniques.
Les Gaz Nobles : Les Éléments Solitaires de la Chimie
Les Asociaux de la Table Périodique
Les gaz nobles, aussi appelés gaz rares, sont une famille d’éléments chimiques qui se distinguent par leur faible réactivité. Ces éléments occupent la dernière colonne du tableau périodique et comprennent l’hélium (He), le néon (Ne), l’argon (Ar), le krypton (Kr), le xénon (Xe) et le radon (Rn). Explorons les raisons pour lesquelles ces éléments sont si peu réactifs et comment cette inertie chimique influence leurs applications.
Configuration Électronique Stable
La caractéristique la plus marquante des gaz nobles est leur configuration électronique extrêmement stable. Chaque gaz noble possède une couche de valence complète, ce qui signifie qu’ils ont le nombre maximal d’électrons dans leur couche externe selon la règle de l’octet (huit électrons pour tous sauf l’hélium, qui en a deux).
Exemple de Configuration Électronique
Prenons quelques exemples de configurations électroniques des gaz nobles :
- Hélium (He) :
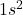
- Néon (Ne) :
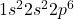
- Argon (Ar) :
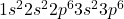
Ces configurations montrent des couches de valence complètes, ce qui rend les gaz nobles très stables et peu enclins à réagir avec d’autres éléments.
Faible Réactivité et Applications
En raison de leur faible réactivité, les gaz nobles ont des applications uniques et précieuses dans divers domaines. Voici quelques exemples :
- Hélium (He) :
- Utilisé dans les ballons et les dirigeables en raison de sa faible densité et de sa non-inflammabilité.
- Employé comme gaz protecteur en soudage et en cryogénie pour ses propriétés inertes.
- Néon (Ne) :
- Utilisé dans les enseignes lumineuses et les lampes à néon en raison de sa capacité à produire une lumière vive et colorée lorsqu’il est excité électriquement.
- Argon (Ar) :
- Utilisé comme gaz protecteur dans les procédés de soudage et de découpe, ainsi que dans les ampoules à incandescence pour prolonger leur durée de vie.
Réactivité Exceptionnelle
Bien que les gaz nobles soient généralement inertes, des composés de gaz nobles ont été synthétisés, principalement avec des fluorures et des oxydes. Ces composés sont souvent formés sous des conditions extrêmes. Par exemple, le xénon peut former des composés tels que le tétrafluorure de xénon (XeF₄) et le dioxyde de xénon (XeO₂).
Exemples de Composés de Gaz Nobles
- Tétrafluorure de xénon (XeF₄) :
- Formé en faisant réagir du xénon avec du fluor à haute température :
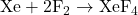
- Hexafluoroplatinate de xénon (XePtF₆) :
- Un composé pionnier de xénon, formé par la réaction de xénon avec du platine hexafluorure :
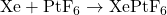
Applications Technologiques
Les gaz nobles, grâce à leurs propriétés uniques, ont trouvé des applications dans des technologies avancées :
- Hélium :
- Utilisé dans les scanners IRM (imagerie par résonance magnétique) pour refroidir les aimants supraconducteurs.
- Employé comme gaz de détection dans les spectromètres de masse en raison de sa faible masse atomique.
- Xénon :
- Utilisé dans les lampes flash pour la photographie et les lampes à décharge pour les projecteurs de cinéma.
- Employé comme propulseur dans les moteurs ioniques pour les satellites et les sondes spatiales en raison de sa masse atomique élevée et de ses propriétés inertes.
Conclusion du Chapitre
Les gaz nobles illustrent parfaitement le concept de stabilité chimique grâce à leurs configurations électroniques complètes. Leur faible réactivité les rend précieux dans des applications où des environnements inertes sont nécessaires. Bien que généralement inertes, certains gaz nobles peuvent former des composés sous des conditions extrêmes, démontrant que même les éléments les plus stables peuvent réagir dans des situations particulières. Dans le prochain chapitre, nous explorerons les conditions extrêmes qui peuvent forcer les atomes à se rapprocher suffisamment pour permettre la fusion nucléaire, une exception rare où les atomes se « touchent » vraiment.
Conditions Extrêmes : Forcer le Contact Atomique
La Fusion Nucléaire : Spectacle Pyrotechnique dans les Étoiles
Sous des conditions normales, les atomes ne se touchent jamais vraiment en raison des forces électromagnétiques qui les maintiennent à distance. Cependant, dans des conditions extrêmes, telles que celles trouvées au cœur des étoiles ou dans les accélérateurs de particules, les atomes peuvent être forcés à se rapprocher suffisamment pour surmonter ces forces. Explorons ces conditions et comment elles permettent des phénomènes comme la fusion nucléaire.
La Fusion Nucléaire dans les Étoiles
Au cœur des étoiles, les températures et les pressions sont si élevées que les atomes d’hydrogène sont ionisés, formant un plasma de protons et d’électrons libres. Ces conditions extrêmes permettent aux protons de surmonter la répulsion électromagnétique et de se rapprocher suffisamment pour que la force nucléaire forte prenne le relais, permettant ainsi la fusion.
La Chaîne Proton-Proton
La réaction de fusion la plus courante dans les étoiles comme notre Soleil est la chaîne proton-proton. Voici les étapes de cette réaction :
- Fusion de Deux Protons :
- Deux protons fusionnent pour former un noyau de deutérium (un proton et un neutron), en libérant un positron (
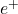 ) et un neutrino (
) et un neutrino (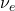 ) :
) : 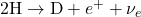
- Deux protons fusionnent pour former un noyau de deutérium (un proton et un neutron), en libérant un positron (
- Fusion du Deutérium et d’un Proton :
- Le deutérium fusionne avec un autre proton pour former un noyau d’hélium-3, en libérant un photon gamma (
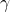 ) :
) : 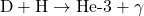
- Le deutérium fusionne avec un autre proton pour former un noyau d’hélium-3, en libérant un photon gamma (
- Fusion de Deux Noyaux d’Hélium-3 :
- Deux noyaux d’hélium-3 fusionnent pour former un noyau d’hélium-4 et deux protons supplémentaires :
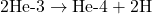
Cette chaîne de réactions libère une immense quantité d’énergie, qui est la source de l’énergie lumineuse et thermique des étoiles.
Accélérateurs de Particules
Les accélérateurs de particules, tels que le Large Hadron Collider (LHC), peuvent également créer des conditions extrêmes où les atomes sont forcés de se rapprocher. Dans ces dispositifs, les particules sont accélérées à des vitesses proches de celle de la lumière et sont ensuite forcées à entrer en collision.
Conditions dans les Accélérateurs
- Énergies Cinétiques Élevées :
- Les particules sont accélérées à des énergies cinétiques très élevées, de l’ordre de plusieurs TeV (tétraélectronvolts).
- Forces d’Interaction :
- Lors des collisions, les énergies sont suffisantes pour surmonter les forces électromagnétiques répulsives, permettant aux particules de pénétrer dans la région dominée par la force nucléaire forte.
Fusion Nucléaire Contrôlée
La fusion nucléaire contrôlée est le Saint Graal des technologies énergétiques, promettant une source d’énergie propre et quasi inépuisable. Des projets comme le réacteur à fusion ITER cherchent à reproduire les conditions des étoiles sur Terre pour réaliser une fusion contrôlée.
Conditions Nécessaires pour la Fusion
- Température Élevée :
- Les noyaux doivent être suffisamment énergétiques pour surmonter la barrière coulombienne. Typiquement, des températures de l’ordre de millions de degrés Kelvin sont nécessaires.
- Confinement :
- Les particules doivent être confinées suffisamment longtemps pour permettre la fusion. Cela peut être réalisé par confinement magnétique (tokamaks) ou confinement inertiel (lasers à haute énergie).
Les conditions extrêmes, comme celles trouvées au cœur des étoiles ou dans les accélérateurs de particules, peuvent forcer les atomes à se rapprocher suffisamment pour surmonter la répulsion électromagnétique et permettre des interactions nucléaires. Ces phénomènes, bien que rares dans des conditions normales, démontrent la puissance et la complexité des forces en jeu à l’échelle atomique. Dans le prochain chapitre, nous conclurons notre exploration en revisitant les concepts clés et en offrant une perspective nouvelle sur le contact à l’échelle humaine et atomique.
Conclusion : Une Perspective Nouvelle sur le Contact
Révélations Atomiques : Quand la Science Défie la Perception
Au cours de notre exploration des concepts atomiques et des forces fondamentales, nous avons découvert que ce que nous percevons comme un contact direct est en réalité une interaction complexe de forces électromagnétiques à l’échelle atomique. Cette perspective bouleverse notre compréhension intuitive du monde matériel et offre une nouvelle appréciation des phénomènes quotidiens.
Récapitulatif des Concepts Clés
- Structure Atomique et Vide :
- Les atomes, constitués d’un noyau central entouré de nuages d’électrons, sont principalement composés de vide. Ce vide représente la majeure partie de l’espace atomique, défiant notre perception de la solidité.
- Forces Électromagnétiques :
- À l’échelle atomique, l’électromagnétisme est la force dominante, des milliards de fois plus puissante que la gravité. Les électrons, chargés négativement, se repoussent, créant une barrière qui empêche les atomes de se toucher directement.
- Répulsion et Principe d’Exclusion de Pauli :
- La répulsion entre les électrons et le principe d’exclusion de Pauli empêchent les atomes de se chevaucher, assurant ainsi la stabilité et la solidité apparente des objets.
- Liaisons Chimiques :
- Les atomes peuvent former des liaisons chimiques (covalentes, ioniques, métalliques) pour créer des molécules et des solides. Ces liaisons résultent du partage ou du transfert d’électrons, mais les atomes ne se touchent jamais vraiment.
- Forces à Très Courte Distance :
- Les forces de van der Waals, y compris les forces de London, de Debye et de Keesom, jouent un rôle crucial dans les interactions à l’échelle nanométrique, permettant des phénomènes comme l’adhérence des geckos.
- Réactions Chimiques et Énergie :
- Les réactions chimiques, où les atomes se réarrangent pour former de nouvelles substances, sont fondamentales pour la transformation de la matière et le transfert d’énergie.
- Stabilité Moléculaire :
- La stabilité des molécules dépend de la nature des liaisons chimiques, de la distribution des électrons et des interactions entre atomes. La stabilité cinétique et thermodynamique influence la réactivité des molécules.
- Gaz Nobles :
- Les gaz nobles, avec leurs configurations électroniques complètes, illustrent la stabilité chimique, étant généralement inertes mais capables de former des composés dans des conditions extrêmes.
- Conditions Extrêmes et Fusion Nucléaire :
- Dans des conditions extrêmes, comme celles des étoiles ou des accélérateurs de particules, les atomes peuvent être forcés à se rapprocher suffisamment pour permettre des interactions nucléaires, libérant une immense quantité d’énergie.
Une Nouvelle Compréhension du Contact
En réinterprétant le contact à travers le prisme de la physique atomique, nous voyons que ce que nous ressentons comme une pression ou une résistance est en réalité le résultat de forces électromagnétiques. Cette compréhension nous permet d’apprécier la complexité et la beauté de l’univers à l’échelle microscopique, où les interactions invisibles dictent les propriétés du monde matériel.
Implications Pratiques et Technologiques
Cette nouvelle perspective sur le contact et les forces atomiques a des implications profondes pour la science et la technologie. Des adhésifs inspirés des geckos aux réacteurs de fusion nucléaire, notre compréhension des forces atomiques ouvre des portes à des innovations qui peuvent transformer notre avenir.
Un Regard Vers l’Avenir
Alors que nous continuons à explorer l’univers à des échelles de plus en plus petites, nous découvrons des phénomènes encore plus étonnants et des applications potentielles qui repoussent les limites de notre technologie. La quête pour comprendre les forces fondamentales et les interactions atomiques est loin d’être terminée, et chaque découverte nous rapproche d’un avenir où la science et la technologie se mêlent pour améliorer notre compréhension et notre qualité de vie.
Conclusion Finale
Le voyage à travers les mystères de l’interaction atomique nous montre que le monde est bien plus complexe et fascinant qu’il n’y paraît. En révélant les forces invisibles qui régissent notre réalité, nous pouvons apprécier la beauté et l’élégance de l’univers à un niveau fondamental. Continuez à explorer, à questionner et à découvrir, car chaque réponse ouvre la porte à de nouvelles questions et à de nouvelles merveilles.
 Pourton.info
Pourton.info 


